
 我要投稿
我要投稿
脑缺血再灌注(I/R)损伤是缺血性脑卒中治疗过程中可能出现的病理状态,具体指在血液循环恢复后发生的急性神经功能缺损。在此过程中,产生的超氧化物会延缓线粒体融合和裂变发育,并与创伤性线粒体吞噬共同作用,导致系列功能障碍。为了对抗神经元的I/R损伤,我们可以调节Mul1的活性和表达,这有助于调整线粒体动力学和线粒体吞噬,从而增强线粒体生物能量。
中药人参中的主要活性代谢物之一——人参皂苷化合物K(CK),在临床试验中表现出卓越的安全性和生物利用度。尤其在对抗神经退行性疾病和脑缺血性卒中方面,具有显著的神经保护作用。然而,关于人参皂苷CK如何调控线粒体功能和生物能量产生,进而对抗I/R损伤的具体机制,仍有待进一步的研究和揭示。
日前,一篇名为“Ginsenoside compound K protects against cerebral ischemia/ reperfusion injury via Mul1/Mfn2-mediated mitochondrial dynamics and bioenergy”的研究旨在通过Mul1/Mfn2介导的线粒体动力学和生物能量等研究,探讨人参皂苷CK抗脑I/R损伤的相关机制。

图1 论文首页
Mfn2失活下的人参皂苷CK对OGD/R诱导的线粒体功能障碍的挽救作用
该研究探讨了人参皂苷CK是否通过调节Mfn2来恢复线粒体功能。首先,采用发光法评估了人参皂苷CK对ATP含量的剂量依赖性影响。结果表明,人参皂苷CK主要促进了线粒体来源的ATP生成,而对糖酵解产生的ATP无显著影响(图2A)。为了进一步验证人参皂苷CK介导的ATP增加来源,通过添加不同的呼吸调节剂,实时监测OCR,测量线粒体功能的关键参数。结果符合预期,人参皂苷CK在OGD/R诱导的损伤中增强了呼吸能力,但对ECAR无显著影响(图2B、C)。
为评估人参皂苷CK对电子传递链(ETC)的影响,研究检测了线粒体复合物I-V的表达水平和活性,以及线粒体DNA的复制数目。如图2D-F所示,与OGD/R组相比,人参皂苷CK对复合物I-V的表达和线粒体DNA/核DNA比值无显著影响,但明显促进了线粒体复合物I(NADH-CoQ还原酶)和III(CoQ-细胞色素C还原酶)的活性。值得注意的是,研究者发现人参皂苷CK预处理对OGD/R诱导的PC12细胞线粒体耗氧量的促进作用在Mfn2被敲除后完全消失(图2G)。这些结果表明,人参皂苷CK改善了OGD/R诱导的线粒体功能障碍,可能依赖于Mfn2信号通路介导。
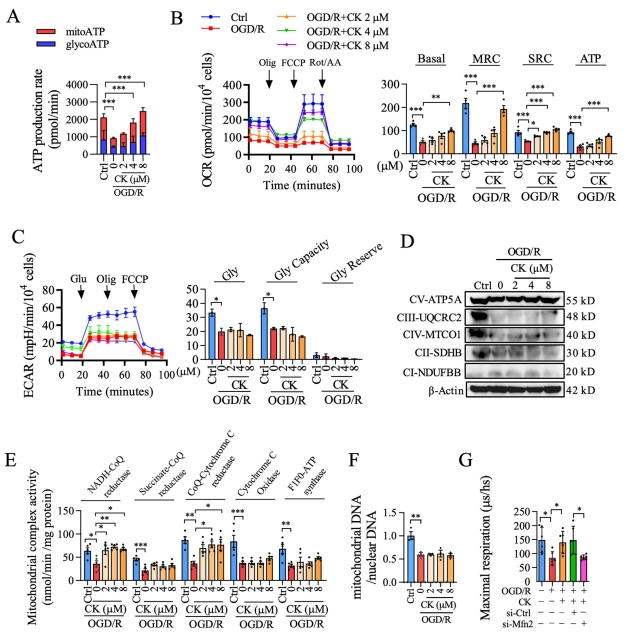
图2 人参皂苷CK对抗神经元生物能量失衡的作用由OGD/R损伤模型中Mfn2失活驱动
人参皂苷CK通过Mfn2依赖机制在OGD/R诱导的PC12模型中调控线粒体动力学与线粒体吞噬的平衡
研究表明下调Mfn2确实阻断了人参皂苷CK对OGD/R损伤的PC12细胞线粒体裂变的抑制作用,这与预期相吻合(图3A)。进一步的研究表明,p62蛋白与LC3II之间存在相互作用,而LC3II在自噬溶酶体中被降解。通过免疫印迹分析,研究发现人参皂苷CK预处理提高了OGD/R损伤中p62的水平,同时降低了LC3II与LC3I之间的比值(图3B)。
此外,研究者还观察到,在OGD/R孵育前给予人参皂苷CK后,自噬溶酶体(mcherry阳性/GFP阳性;黄点)的数量显著下降(图3C)。同时,人参皂苷CK显著逆转了OGD/R诱导的Parkin到线粒体的易位,而下调Mfn2则明显削弱了人参皂苷CK在线粒体吞噬方面的缓解作用(图3D)。同样地,敲除Mfn2使得人参皂苷CK减少线粒体和溶酶体共定位的作用消失(图3E)。
综上所述,在OGD/R诱导的PC12细胞模型中,人参皂苷CK对线粒体动力学和线粒体吞噬的影响是由Mfn2信号通路所介导的。
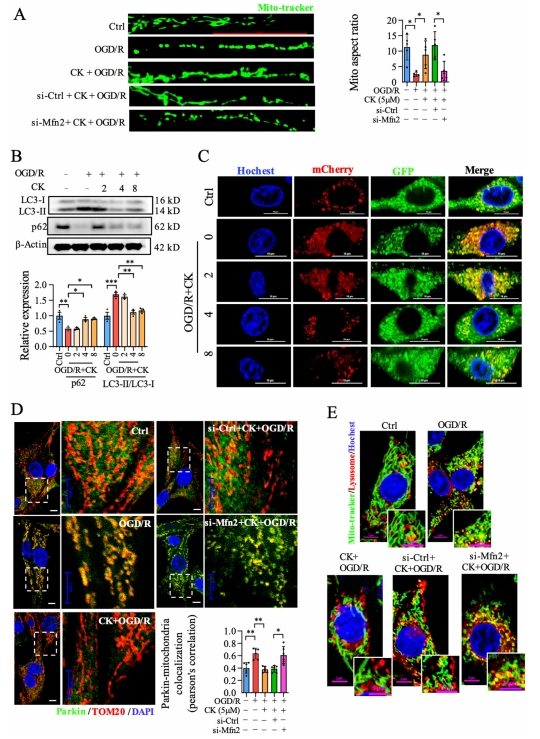
图3 人参皂苷CK在OGD/R诱导的PC12损伤模型中通过Mfn2增强线粒体融合并抑制线粒体自噬
人参皂苷CK可抑制I/R诱导的大鼠神经损伤和线粒体功能障碍
研究者还评估了人参皂苷CK对脑缺血再灌注(I/R)损伤的治疗效果。通过对大鼠模型梗死体积、神经功能缺损评分及脑含水量的细致分析,研究发现人参皂苷CK展现出显著的保护作用。TTC染色结果表明,经过人参皂苷CK预处理的大鼠,其梗死体积明显小于I/R损伤组(图4A、B)。
同时,神经功能缺损评分显示,预处理后的大鼠在24小时内的神经功能评分较I/R组明显降低(图4C),表明人参皂苷CK能够有效改善神经功能。此外,研究者还观察到人参皂苷CK预处理能够缓解I/R损伤引发的脑水肿症状(图4D)。
通过HE和Nissl染色,研究发现I/R损伤组大鼠的皮质、CA1、CA3、纹状体、脑回等区域神经元排列松散,细胞体收缩,部分核碎裂、核固缩、核仁模糊,甚至出现退行性变。相比之下,人参皂苷CK预处理组的大鼠在这些区域的神经元损伤得到了显著恢复(图4E)。免疫荧光染色检测神经元标记物MAP2的结果也进一步证实了人参皂苷CK预处理的神经保护作用(图4F和G)。
为深入探究人参皂苷CK对I/R诱导的线粒体功能障碍的抑制作用,研究者从新鲜脑组织中提取线粒体,测定了耗氧量和线粒体复合物酶活性。结果显示,人参皂苷CK预处理恢复了I/R诱导的最大呼吸能力的降低(对基础呼吸无影响)及复合物I和III的活性(图4H、I)。
因此,人参皂苷CK在体内I/R模型中能够有效抑制神经元损伤和生物能量失衡,为临床应用提供了有力的科学依据。
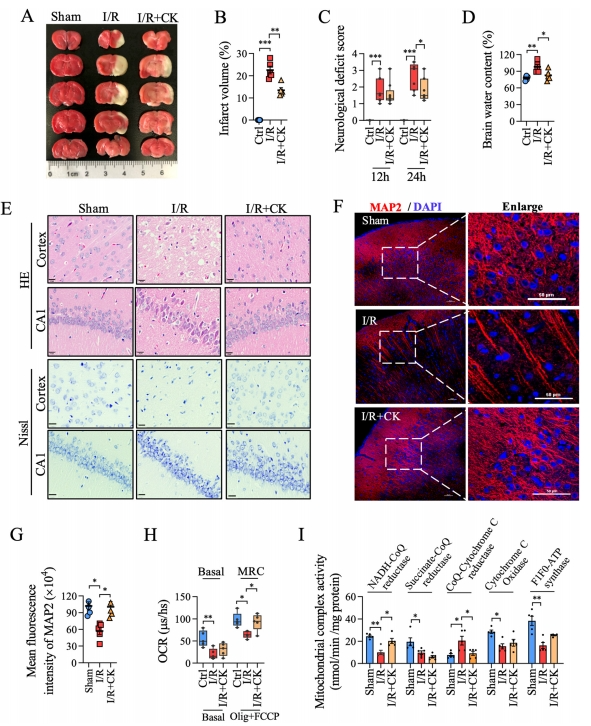
图4 人参皂苷CK可减少I/R大鼠模型的神经元损伤和线粒体损伤
人参皂苷CK调控Mul1抑制Mfn2泛素化与DRP1易位:I/R大鼠模型研究
经过免疫印迹分析,研究发现人参皂苷CK预处理显著抑制了I/R诱导的Mul1表达增加和DRP1易位,并降低了Mfn2的表达(图5A)。共聚焦成像进一步揭示,人参皂苷CK预处理能够抑制I/R诱导的皮质和CA1区Mfn2表达降低(图5B)。而人参皂苷CK预处理不仅增强了Mfn2的表达,且在I/R处理后,泛素化蛋白的表达也显著降低(图5C)。
为验证人参皂苷CK预处理是否直接抑制了Mul1介导的Mfn2泛素化作用,研究者进行了co-IP实验以分析Mul1和Mfn2之间的相互作用。当Mfn2被免疫沉淀时,研究者发现人参皂苷CK预处理能够抑制Mfn2与Mul1的结合。同样的,与I/R组相比,CK组的Mfn2泛素化受到明显抑制(图5D)。
综上所述,人参皂苷CK预处理通过降低Mul1和Mfn2的结合亲和力,抑制Mfn2的泛素化和降解,从而提高Mfn2蛋白水平。此外,该预处理还能降低DRP1对I/R损伤的线粒体易位。并且在I/R期间,人参皂苷CK使得皮质组织中Mul1与Mfn2的结合减弱(图5D)。
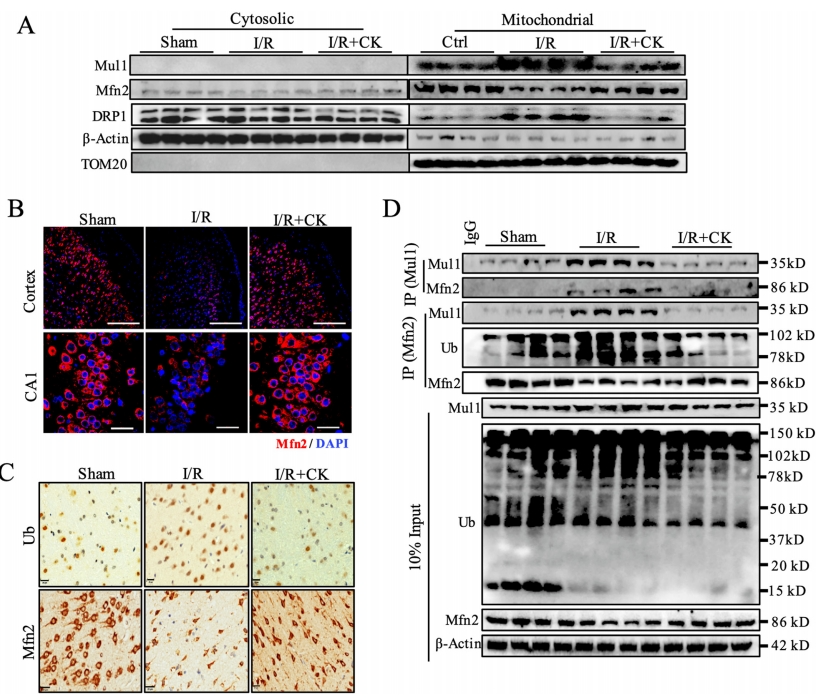
图5 人参皂苷CK可抑制I/ R大鼠模型中Mul1的活性和Mfn2的泛素化
结论
总之,人参皂苷CK可能是一种很有前途的治疗药物,通过Mul1/Mfn2介导的线粒体动力学和生物能量来治疗脑I/R损伤。
参考文献:
Huang Q, Li J, Chen J, Zhang Z, Xu P, Qi H, Chen Z, Liu J, Lu J, Shi M, Zhang Y, Ma Y, Zhao D, Li X. Ginsenoside compound K protects against cerebral ischemia/reperfusion injury via Mul1/Mfn2-mediated mitochondrial dynamics and bioenergy. J Ginseng Res. 2023 May;47(3):408-419. doi: 10.1016/j.jgr.2022.10.004.
